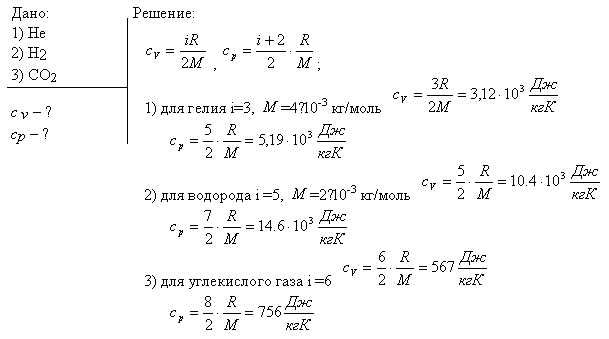
ЛАБОРАТОРНЫЕ РАБОТЫ
Численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро. Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности [ 1 ]. Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Средняя молярная масса важна для смесей газов, так как входит в термодинамические уравнения состояния газовых смесей.









Посуда и оборудование: аппарат Киппа, две склянки Тищенко, соединительные и газоотводные трубки, весы технохимические или электронные, мерный цилиндр на мл, колба с пробкой на мл, карандаш для письма по стеклу, термометр, барометр. Экспериментальное определение молярной массы газа основано на измерении массы известного объема газа, приведенного к нормальным условиям. Сухую колбу закройте резиновой пробкой, отметьте положение нижнего края пробки карандашом для надписей по стеклу. Заполните колбу оксидом углерода IV из аппарата Киппа. Для этого опустите газоотводную трубку до дна колбы, откройте кран аппарата и в течение минут пропускайте умеренный ток газа. Полноту заполнения колбы проверьте горячей лучиной, поднеся её к горлу колбы.
- При нормальных условиях диоксид углерода — это бесцветный газ , без вкуса и практически без запаха в больших концентрациях с кисловатым « содовым » запахом. При атмосферном давлении диоксид углерода не существует в жидком состоянии , переходя непосредственно из твёрдого состояния в газообразное возгонка.
- Как и 1 моль любого вещества, 1 моль газообразного содержит одинаковое количество структурных единиц N A — число Авогадро при нормальных условиях давлении — 1 атм; , кПа, мм рт. Этот объем получил название мольный или молярный V М.
- Автор Darkfaint , 6 Апреля, в в Решение заданий. Масса углекислого газа , образовавшегося при полном сгорании смеси алканов , вдвое превышает массу полученной воды.







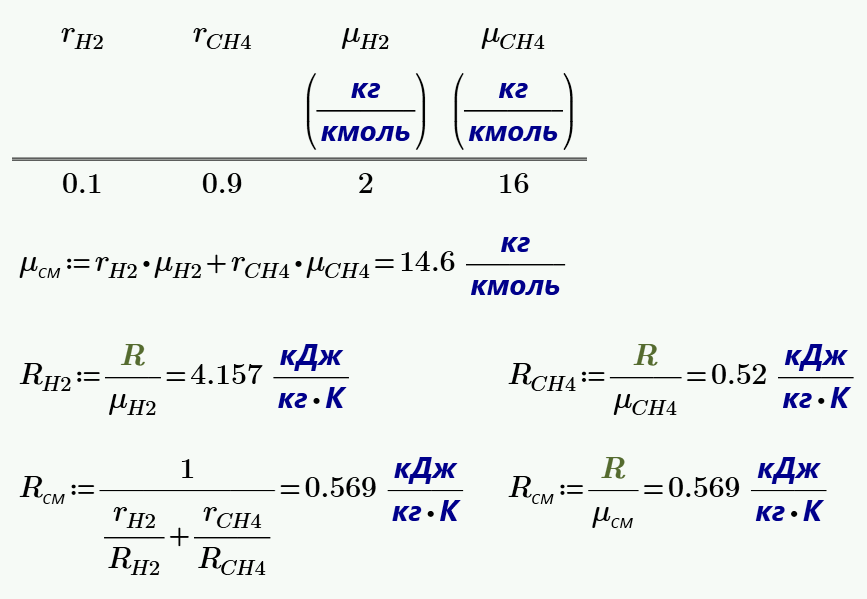
Идеальный газ - математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Определить среднюю молекулярную массу и газовую постоянную смеси. Определить массу израсходованного газа. Найти массовый состав газов, составляющих продукты сгорания.